커뮤니티2
CZ/SK 비즈니스/법률
체코 시장진출을 위한 의료기기 인증절차 알아보기(2016.12.13)
체코 시장진출을 위한 의료기기 인증절차 알아보기
- EU 지정 인증기관에서 발급한 CE인증 필수 -
- 체코 의약통제청(SUKL)에 취급자 및 의료기기 제품 등록 필요 -
□ 체코 의료기기 시장동향
ㅇ 체코의 의료관광 증가 및 노후화된 의료기기에 투자 등의 요인으로 체코 의료시장은 최근 확대되는 추세임. BMI 보고서에 따르면, 2017년에도 의료기기 시장이 3.9% 확대될 것으로 전망
ㅇ 체코 의료기기는 국내 제조업체의 제품 품질이 향상되고 있음에도 아직까지는 대부분이 수입에 의존하고 있음.
- 2016년 1월에서 9월까지 수입현황을 살펴보면, 유럽국가로부터 수입이 55%로 가장 큰 비중을 차지하며, 그 뒤를 이어 미주 25%, 아시아가 20%의 비중을 차지함.
- 국가별로는 독일, 미국에서 가장 많이 수입하고 있으며, 한국은 2016년 기준(1~9월) 수입국 중 17위를 기록함.
- 한국에서 주로 수입하는 품목은 진단기기(HS Code 9018)와 엑스선 촬영기(HS Code 9022)이고, 2015년에는 전년대비 16.9%, 2016년(1~9월)에는 35.1%로 증가하는 추세임.
체코 의료기기 국가별 수입동향
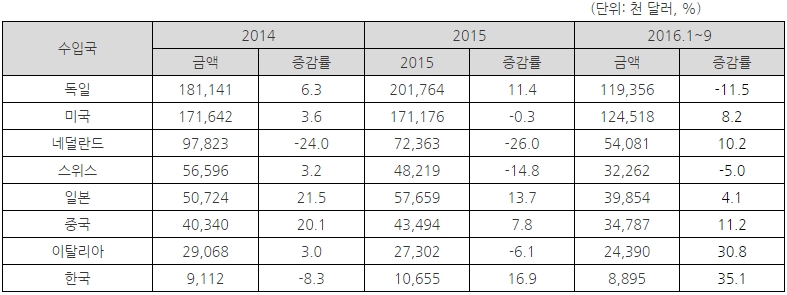
자료원: 체코 통계청
□ 의료기기 CE인증 관련 EU지침
ㅇ 의료기기는 기기분야별 3가지 EU지침에 의해 규정
- 일반 의료기기: Medical Devices Directive(MDD) 93/42/EEC
- 체외진단용 의료기기: In Vitro Diagnostic Medical Devices Directive(IVD) 98/79/EC
- 능동삽입용의료기기: Active Implantable Medical Devices Directive(AIMD) 90/385/EEC
ㅇ 의료기기의 등급분류는 93/42/EEC Annex IX에 명시돼 있으며, 사용상의 사용자 위험에 따라 Class I, Class Ⅱa, Class Ⅱb, Class III 등의 4등급으로 분류돼 각 등급에 따라 추후 적용되는 절차가 상이함.
- 등급분류 방법에는 18가지의 룰이 적용되며, 룰 1에서 12는 의료기기를 일반적인 기준, 특정 삽입성, 지속적인 접촉 기간, 조직접촉 특성 그리고 능동성(Active)과 비능동성(Non-active) 등에 따라 의료기기를 분류함. 룰 13에서 18은 특별한 경우에 대한 룰임.
- Class III으로 분류되는 유방보형물(Breast implants)의 경우, 2003/12/EC의 지침에 따라 기준이 정의됨.
- 고관절, 슬관절, 견관절 대체물의 경우 Class III으로 분류됨(2005/50/EC 지침).
- 등급분류에 대한 가이드라인 및 경계에 있는 제품 분류는 아래의 문서 참고
∙ MEDDEV 2.4/1 Rev. 9 Guidelines for the Classification of Medical Devices
∙ MEDDEV 2.1/3 Rev. 3 Borderline products
□ 의료기기 CE인증 절차
ㅇ 의료기기를 체코를 포함한 유럽국가에서 유통 및 판매하기 위해서는 반드시 CE 인증을 받아야 하며, CE마크가 없을 경우에는 유통에 제한이 있을 수 있음.
ㅇ 의료기기 CE인증을 받기 위해서는 유럽연합에서 지정한 의료기기 인증기관(Notified Body)을 통해서 발급받아야 함.
- 유럽연합 인증기관 정보 시스템[NANDO(New Approach Notified and Designated Organisations) Information System]에서 유럽 국가별, 분야별로 인증기관 확인 가능
- 의료기기 체코 인증기관
· EZU(Electrotechnical Testing Institute): http://ezu.cz
· ITC(Institute for testing and certification): http://www.itczlin.cz(한국지사 운영)
ㅇ CE인증을 위해서는 의료기기에 대한 기술문서, 위험분석, 지침의 필수요건을 준수한다는 증명, 제조사에 의한 적합성 선언(Declaration of conformity) 등이 요구됨.
ㅇ 일반적인 의료기기 CE인증 절차(각 인증기관마다 절차가 상이할 수 있음)
① EU 지침에 따른 의료기기 범위에 해당하는지, 어떤 EU 지침에 적용을 받는지 판단
② 의료기기가 어느 등급에 속하는지 판단
③ 인증기관(NB)과 접촉해 사전논의 및 정보교환 후 인증기관 선택
④ 인증기관에서 요구하는 구체적인 질문에 답변(보통 인증기관에서 제공하는 질의서 양식 작성)
⑤ 인증기관에서는 의료기기 등급책정, 각 등급별 선택 가능한 인증절차, 절차별 예상되는 시간 및 비용을 산출해 통보하면 제조사에서 인증절차를 선택
⑥ 정식 신청서와 인증진행계약 작성
⑦ 인증기관에서 요구하는 기술문서 등 서류 및 샘플(필요한 경우) 제출 / 인증기관은 제출된 서류 평가 및 보고서 작성
⑧ 제조사 및 공급자의 제조시설 감사(적용 가능하고 필요한 경우)
⑨ CE 인증 결정 및 발급(유효기간 5년)
⑩ 인증기관은 매년 감사를 실시하며, 유효기간인 5년 후 새로운 인증발급을 위해서는 전반적인 감사 실시
□ 체코 내 유통을 위한 절차
ㅇ 의료기기를 체코 내 유통 및 판매하기 위해서는 사전에 CE인증을 획득해야 하며, 체코 의약통제청(SUKL)에 의료기기 취급자 및 제품 등록을 해야 함.
- 체코 의약통제청(SUKL: State Institute for Drug Control): www.sukl.cz
- 체코 의료기기 관련지침: Act on Medical Devices 268/2014 Coll.
· 지침 다운로드 링크: http://www.sukl.eu/medical-devices/act-on-medical-devices
ㅇ 의료기기 취급자 등록
- 의료기기 취급자는 의료기기를 제조하거나 체코 내에서 의료기기를 유통 및 수입 또는 의료기기를 이용한 서비스를 제공하는 자를 의미함.
- 체코 내에서 의료기기를 취급하는 자(제조, 유통, 수입, 서비스 제공)는 체코 시장에서 의료기기 관련 활동을 하기 이전에 체코 의약통제청에 반드시 취급자 등록을 해야 함. 의료기기 위험등급 Class I 에 해당하거나 일부 체외진단용 의료기기(IVD)의 경우는 취급자 등록이 필요하지 않음.
ㅇ 의료기기 취급자 등록 절차
- 2015년 5월 1일 자로 체코 의약통제청은 신 의료기기 등록시스템(RZPRO: Registry of Medical Devices)을 도입해 의료기기 취급자 및 제품의 등록절차를 인터넷으로 진행하고, 등록된 정보를 웹사이트에서 조회할 수 있는 시스템을 마련함.
· 등록 및 조회사이트 링크: https://eregpublicsecure.ksrzis.cz/Registr/RZPRO/
- 등록 사이트에 접속해 회원가입 후 로그인 정보를 이메일로 받은 후, 등록화면에서 이름, 연락처, 관련 활동(제조·유통·수입·서비스 제공 등 – 같은 취급자가 다수 활동 선택 가능)을 기입 후 등록
- 고객의 요청에 의해 주문 제작(Custom-made)한 의료기기의 경우, 국제의료기기명명법(GMDN: Global Medical Device Nomenclature)에 등록된 GMDN 코드가 필요함.
- 의료기기를 사용하는 서비스 제공자의 경우, 사용하는 의료기기의 제조사 정보 및 제조사에 의해 사용법을 교육받았다는 증명서가 필요함.
- 등록 후 승인이 완료되면 의약통제청에서 등록번호를 발급하며, 등록 유효기간은 5년으로 만료일 최소 2개월 전(최대 6개월부터)에 연장 신청을 해야 함. 최종 등록된 정보는 의료기기 등록시스템에 게시됨.
ㅇ 의료기기 제품 등록
- 체코 내에서 의료기기를 출시하는 제조자(또는 체코 내 제조자의 법적대리인) 및 유통하거나 수입하는 자는 체코 시장에 제품을 출시한 날로부터 최소 15일 이내에 체코 의약통제청에 반드시 해당 의료기기 제품 등록을 해야 함.
ㅇ 유통·수입자에 의한 의료기기 제품 등록절차
- 동일한 등록 사이트에 접속해 등록화면에서 유통사 또는 수입사 등록번호, 제조사 정보, 의료기기 상호, 사용목적(체코어), 각 제품을 규정하는 보충설명, 각 제품별 제조사 고유번호, 적합성 평가(conformity assessment)의 인증정보(CE 인증번호, 인증기관 번호, 인증발급처), 체코어로 된 사용자 설명서(Class I, Class Ⅱa 제품의 경우 제조사가 의료기기 사용자의 안전을 위해 필요하지 않다고 규명하면 필수는 아님) 등의 정보를 입력 후 등록
- 심사 후 승인이 완료되면 의약통제청에서 등록번호를 발급하며, 등록 유효기간은 5년으로 만료일 최소 2개월 전(최대 6개월부터)에 연장 신청을 해야 함. 최종 등록된 정보는 의료기기 등록시스템에 게시됨.
□ 시사점
ㅇ 의료관광 증가로 의료기기 수요 증가 전망
- BMI 보고서에 따르면, 체코는 높은 의료수준과 타 유럽국 대비 현저히 낮은 의료비로 인해 최근 몇 년간 의료관광의 중부유럽 허브로 부상 중
- 또한, 2013년 유럽 내 타국에서 의료비 선지급 후 본국에서 보상받을 수 있도록 규정된 EU 지침(2011/24/EU)으로 인해 의료관광객이 늘고 있어, 2015년 대비 체코의 의료관광 시장은 15% 증가함. 주로 성형 시술, 안과 시술, 관절 대체시술 분야에서 관광객이 증가하고 있음.
| 번호 | 제목 | 글쓴이 | 날짜 | 추천 | 조회 |
|---|---|---|---|---|---|
| 15 | 슬로바키아의 와인 생산 현황(2016.10.25)[슬로바키아 정보/뉴스] | 운영진 | 11.01 | 0 | 1,655 |
| 14 | 체코, 10월부터 신 공공조달법 시행(2016.10.11) | 운영진 | 10.18 | 0 | 1,672 |
| 13 | 브렉시트 가결에 따른 EU내 기업 대응 방안 (EY, Ernst & Young) | 운영진 | 07.11 | 0 | 2,322 |
| 12 | 조세 제도 | 운영진 | 01.04 | 0 | 3,897 |
| 11 | Czech Tourism - Country report - South Korea | lukas | 04.17 | 0 | 1,889 |
| 10 | 노무관리(2/2)(노무일반) | 운영진 | 01.04 | 0 | 3,259 |
| 9 | 노무관리(1/2)(임금) | 운영진 | 01.04 | 0 | 2,565 |
| 8 | 출입국 및 비자제도 (6)(체류/출입국 수속 및 세관신고) | 운영진 | 02.04 | 0 | 3,155 |
| 7 | 출입국 및 비자제도 (5)(워킹홀리데이 비자-Working holiday visa) | 운영진 | 02.04 | 0 | 2,663 |
| 6 | 출입국 및 비자제도 (4)(고용카드-Employee Card) | 운영진 | 02.04 | 0 | 2,649 |
| 5 | 출입국 및 비자제도 (3)(장기체류허가 연장) | 운영진 | 02.04 | 0 | 3,128 |
| 4 | 출입국 및 비자제도 (2)(영주권 신청절차) | 운영진 | 02.03 | 0 | 2,847 |
| 3 | 출입국 및 비자제도 (1) (비자 일반 및 장기체류비자 신청) | 운영진 | 02.02 | 0 | 9,282 |
| 2 | Ernst & Young 제공 Biz Info | 운영진 | 01.31 | 0 | 2,584 |
| 1 | 비즈니스 에티켓 | 운영진 | 01.31 | 0 | 2,523 |

